ヒト血清アルブミンへのヒトラクトフェリンの融合により、がん細胞への集積性が飛躍的に高まることを発見
~抗がん剤など薬物送達技術などに応用期待~
東京工科大学(東京都八王子市、学長:香川豊)大学院、バイオ?情報メディア研究科の佐藤淳教授、同栗本大輔博士課程学生らの研究グループは、ヒト血清アルブミン(以下、HSA)にヒトラクトフェリン(以下、hLF)を融合させることで、HSAのがん細胞内への取り込みが飛躍的に向上することを見出しました。抗がん剤など薬物送達を促進するDDS技術(注1)としての応用が期待されます。
本研究成果は、2023年10月1日(現地時間)に欧州薬学連合が発行する専門誌「European Journal of Pharmaceutical Sciences」オンライン版に掲載されました。また、hLFを用いたバイオ医薬品開発のベンチャー企業(注2)において、がんや脊髄損傷、敗血症、急速進行性糸球体腎炎などの治療薬の開発に着手しています。
【研究背景】
がん細胞への薬剤の集積を目的として、がんに対する薬剤とヒト血清アルブミン(HSA)を結合させ、ナノ粒子化した製剤が実用化されています。この製剤は、HSAががん細胞表面に存在する受容体に結合し、細胞内への取り込みシグナルを活性化することで、ナノ粒子ががん細胞内に取り込まれることで機序します。HSAのがん細胞内取り込みシグナルは、通常は活性化されにくいことから、本研究では、hLFの融合によりシグナルが向上し、がん細胞内への取り込みが高まる可能性について検証することを目的としました。
【研究成果】
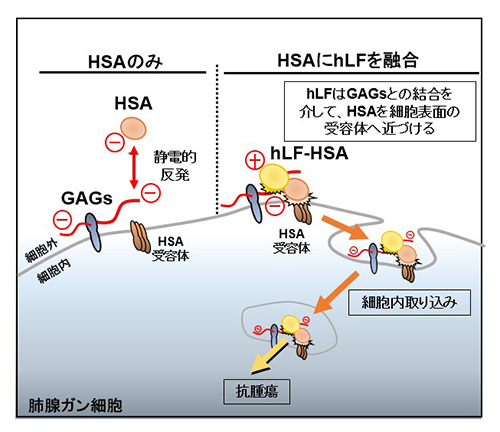
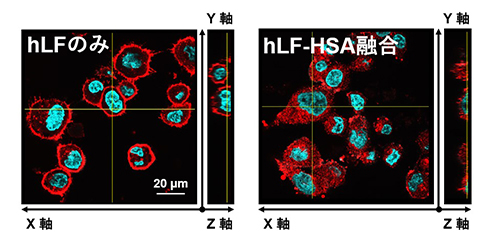
HSAは負に帯電する酸性タンパク質です。一方がん細胞表面には、負に帯電する糖鎖である硫酸化グリコサミノグリカン(GAGs)が存在しており、静電的反発によりHSAは細胞表面に近づくことが難しく、細胞内取り込みシグナルを十分に活性化できないことがわかりました(図1)。hLFは、GAGsと結合する性質を有しており、主に細胞表面に集積します(図2/左)。一方、HSAにhLFを融合させたタンパク質(hLF-HSA)は、その細胞内集積が飛躍的に向上しました(図2/右)。hLF-HSAのhLFは、がん細胞表面のGAGsと結合する際に、融合したHSAを強制的に細胞表面へ近づけており、その結果、受容体への結合が促進され、がん細胞への集積が飛躍的に高まることを明らかにしました(図1)。
【社会的?学術的なポイント】
がん治療ではHSAのナノ粒子がすでに実用化されていますが、HSAの代わりにhLF-HSAを使用することで、がん細胞への集積性がさらに向上することが期待されます。また、hLFは自然免疫で機能するタンパク質であり、抗腫瘍活性を示すことがわかっています。hLFにHSAを融合することで、がん細胞内取り込みが向上するとともに、その抗腫瘍活性も増強されることから、hLF-HSAの抗がん剤としての開発が期待されます。
【論文情報】
論文名:Daisuke Kurimoto & Atsushi Sato, Enhanced intracellular uptake of an albumin fusion protein in cancer cells by its forced cell surface recruitment.
掲載誌:European Journal of Pharmaceutical Sciences
掲載URL:https://doi.org/10.1016/j.ejps.2023.106591
【用語解説】
(注1) DDS: 薬物送達システム、薬剤を体内の疾患に関係する特定部位に送達する技術。
(注2) 株式会社S&Kバイオファーマ (本社: 神奈川県川崎市、代表: 加賀谷伸治)
ホームページ:https://skagayasandk.wixsite.com/website
■東京工科大学大学院 バイオ?情報メディア研究科 佐藤 淳(生物創薬)研究室
遺伝子組換え、生化学、細胞培養技術を基盤とした生物創薬に関する研究を行っている。
工学的な発想で、創薬という「モノ作り」を推進している。
[主な研究テーマ]
1. 自然免疫で機能する多機能性タンパク質であるラクトフェリンの機能解析(特に抗腫瘍作用)
2. 体内安定性を高めたラクトフェリンのバイオ医薬品としての開発(がん、脊髄損傷、敗血症など)
3. 疾患に関連する糖鎖を標的とするバイオ医薬品の開発
4. ファージディスプレイ法を用いた新規機能ペプチドの創製(hLF模倣ペプチドの開発)
■大学院バイオニクス専攻WEB:
/grad/bs/index.html


