生物工学を駆使して、簡便で副作用のない新しい薬を創り出そう!
応用生物学部 佐藤 淳 教授

バイオテクノロジーを駆使した医薬品づくりに取り組む佐藤先生。前回の取材では、食品由来のタンパク質“ラクトフェリン”の医薬品化や人工的な配列からタンパク医薬品を生み出す研究について伺いました。今回はそれらの研究の展開や新たな試みについてお話しいただきました。
過去の掲載はこちらから→ /interesting/016153.html
■前回の取材で、ラクトフェリンの医薬品化について伺いましたが、その後、どんな進展がありましたか?
前回、ラクトフェリンというミルクから取れる多機能性タンパク質を医薬品として利用するため、ポリエチレングリコール(PEG)とラクトフェリンを結合させた“PEGラクトフェリン”というものを開発して、研究を進めているとお話ししました。このPEGラクトフェリンは、血中での安定性が得られ、動物実験でも腸からうまく吸収されるという良い結果が出たのですが、反面、問題点も出てきました。ひとつは、量の問題です。PEGラクトフェリンは、口から飲む経口投与薬として開発していますが、注射剤や血液に直接注入するものと比べると、飲む量が大量に必要になります。たくさん飲まないと、なかなか血中まで移行しないのです。大量にPEGが必要となると、コストの問題が出てきます。この研究は企業と一緒に取り組んでいるので、その辺はシビアです。また、品質管理の問題もあります。PEGは化学修飾ですから、薬にするには、どの部分を修飾するか制御しなければなりません。ところがPEGの性質上、現状の技術ではそのコントロールは難しい。つまり、ものづくりで重要となる品質管理が難しいのです。
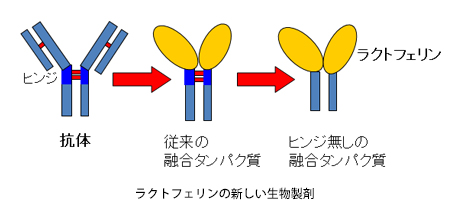
こうした問題を克服しようと、今、研究室では、PEGではなく人の血液中に存在する抗体“IgG”の一部とラクトフェリンを遺伝子組換え技術で融合させた生物製剤の開発に取り組んでいます。このIgGの一部を融合させる方法は、タンパク質医薬品の安定化方法としては、すでに確立されているものです。ただ、従来法には2つの大きな問題があります。ひとつは、抗体の一部に“Hinge(ヒンジ)”と呼ばれる部分があって、そこが分解されやすいという問題です。もともと抗体には、抗原を見つけて捕まえるという役割があるので、抗原の大きさに合わせてフレキシブルに動く性質があります。Hingeは、そのクッションのような役目を担っていて、ぐらぐらと揺れやすいため、体内にあるタンパク質を壊す酵素から狙われやすく、分解されやすいのです。それからもうひとつの問題は、Hingeを含む抗体全体(Fc)を使うと免疫系を活性化してしまい、薬として投与したものが免疫系に外敵だと思われて排除されてしまう可能性があるという点です。そこで当研究室では、遺伝子組換え技術でHingeをなくした新しい融合タンパク質を開発しました。現在は、その新しい融合タンパク質が、遺伝子組換え技術で大量につくれるかということと、通常のラクトフェリンと比較して、性質が変わっていないかということを調べているところです。現状、どちらも問題ないことが確認できています。また、この新しい融合タンパク質は熱安定性が高く、動物実験により血中での安定性もPEGラクトフェリンと同等かそれ以上に良いという結果が得られているので、期待できそうです。
それからラクトフェリンに関しては、もうひとつ、別の観点での研究も進んでいます。
■それはどういう研究ですか?
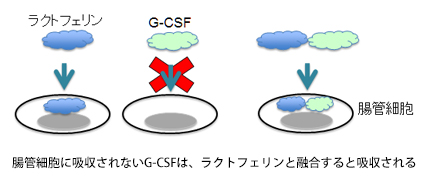
今までお話ししてきた研究は、ラクトフェリンを薬にすることを目標としたものですが、もうひとつの研究はラクトフェリンの面白い性質を活かして、薬を必要な部位に届ける、いわゆる運び屋さんのような役割で使えないかという研究になります。ラクトフェリンはタンパク質で、非常に大きな分子です。通常、タンパク質は胃で分解されて、アミノ酸になり、小腸で栄養として吸収されています。ところがラクトフェリンは、胃で分解されなかったものが腸まで達すると、腸管から分子ごと吸収されて全身に作用するという面白い性質を持っているんです。他方、一般的なタンパク質を使った医薬品は、基本的に腸管から吸収されないため、飲み薬としては存在しません。わざわざ病院へ行き、痛い思いをして注射を打たなければならないのです。それを飲み薬にできれば、非常に汎用性が高まるだろうと考えて、研究を進めています。
具体的には、腸管から直接吸収されないタンパク性の医薬品とラクトフェリンとを遺伝子組換えで融合させ、その融合させた分子をラクトフェリンのルートを使って腸管から吸収させようというものです。実際、G-CSFという白血球を増やすタンパク性の薬をモデル分子として用いてラクトフェリンと融合させ、ヒトの小腸の細胞に吸収されるかどうかの実験を行ってみたところ、きちんとラクトフェリンのルートで吸収されました。また、腸管の細胞で吸収させるには、ラクトフェリン全体が必要なわけではなく、その一部分だけでもうまくいくことが判明しています。ですからラクトフェリンの一部を使って、本来は腸管から吸収されないタンパク性の医薬品を吸収させられるようにしようと、研究を進めているところです。今後は動物実験を行って、さらに詳しく調べていこうと思っています。
■前回は、サイトカインというタンパク質の機能と同じ機能を持つものを人工的につくる研究もご紹介しましたが、その研究にはどんな進展がありましたか?
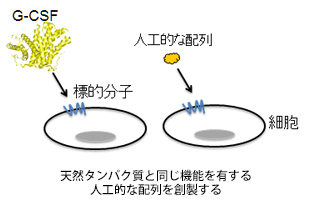
遺伝子組換え技術による人工的な配列を使って、機能のあるものをつくるという研究ですね。これには、新しい動きがありました。この研究の第一関門は、人工的な配列から標的となる分子に結合する分子を、簡便に効率良く取ってくる方法を見つけることでした。これまで、そういう方法がなかったのですが、研究室では遂にその方法を開発することができ、昨年、学会発表を行ったところです。これは非常に大きなブレイクスルーだったと言えます。ですから現在、研究は次の段階に入っています。今は、先ほども出てきたG-CSFという白血球を増やすタンパク性の薬が結合する受容体を遺伝子組換えでつくり、当研究室で開発した方法で、それに結合するものを人工的な配列から取り出しているところです。取り出したものは、受容体に結合する性質があるものですが、中にはそれ以外の活性を示すものもいるのではないかと期待して調べています。ここでいう活性とは、G-CSFと同じように白血球を増やすような作用のことです。つまり、タンパク性で分子の大きいG-CSFの代わりになるもので、尚且つ低分子のものを人工的につくれないかと取り組んでいます。
■こうした研究に、学生はどのように関わっているのですか?
私の研究室はちょっと変わっていて、企業のように開発研究型のチーム体制をとっています。ラクトフェリンの創薬を目指すチーム、ラクトフェリンを材料として医薬品を送達するものをつくるチーム、まったく人工的な配列から何か機能のあるものをつくるチームの3チームがあって、学生はいずれかのチームに所属し、研究を進めていくうえで出てくる様々な課題を各自分担して、研究していきます。これが卒業研究になります。ただ、チームごとに分断されているわけではなく、チーム同士でシェアする技術が多かったり、G-CSFのように同じ材料を使ったりして、重複する部分があるように工夫しています。そうすることで、チーム間の協力や効率化を図ることができますから。
また、当研究室の目標は、薬をつくることです。他大学には薬学部など、薬を研究する学部がありますが、本学は工学系なので企業と一緒に、市場に出すことができる薬をつくることが目標になります。それは非常にハードルの高いことですが、その分、学生の意識は高く、世の中に役立つものをつくりたいという熱意を持っています。それにこの研究室では、ベンチャー企業などと一緒に研究開発を進めていきますから、学生に報告書を書いてもらうなど、企業への提出物を作成してもらうことも多々あります。決められた期限内に一定のクオリティのものをきちんと出すという、社会で経験するようなことを学部生の頃から経験できることは、大きなメリットだと思いますね。
■最後の今後の展望をお聞かせください。
ラクトフェリンをきっかけに、今、非常に興味を持っているのが腸管です。腸管には腸管免疫というものがあって、体内の免疫細胞の約6割が集まっていると知られています。ということは、集まっているところに働きかければ、非常に効率的に免疫系を利用した薬がつくれるのではないかと考えています。具体的に挑戦してみたいのは、経口ワクチンの開発です。ワクチンのほとんどは、注射によって免疫を活性化させますが、腸管を通して免疫を活性化させるものをつくれないかと。もし実現すれば、注射しなくて良い、痛くないワクチンが誕生します。そういうことを可能にするのが、工学の力なのだと思いますね。
■生物創薬(佐藤淳)研究室
/info/lab/project/bio/dep.html?id=5
■応用生物学部WEB
/gakubu/bionics/index.html
?次回は6月14日に配信予定です。


